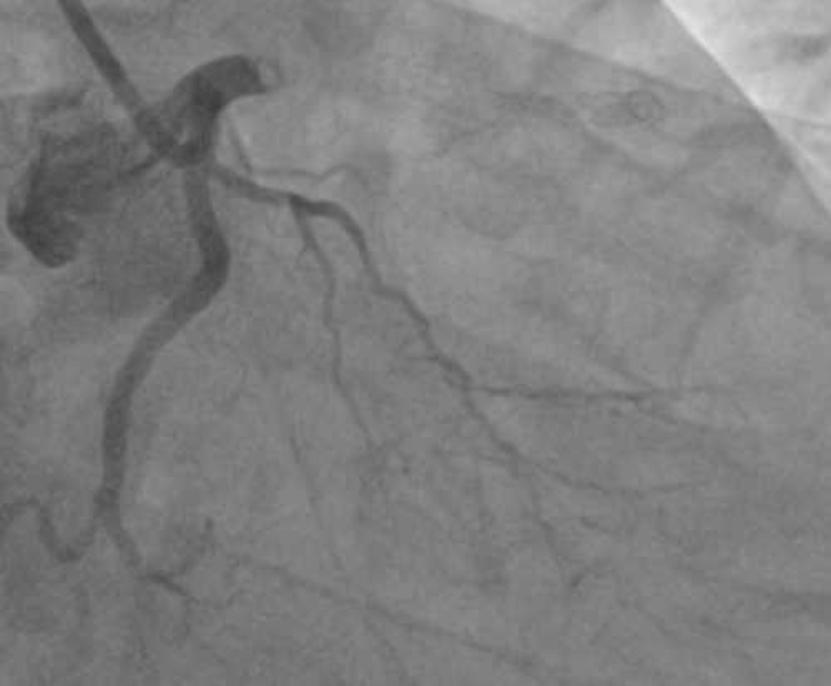
图2. 术后LAD支架内血栓
讨论
患者发生反复支架内急性血栓形成,发病原因及处理策略值得探讨。DES有效解决了PCI术后再狭窄问题,但同时带来内皮化延迟,患者必须接受长期双联抗血小板治疗,阿司匹林加氯吡格雷是目前的常规选择。术后支架内血栓形成是PCI治疗的严重并发症,临床后果严重,Ong等观察支架术后30天内经造影证实有支架内血栓者的30天死亡率为15%,非致死性心肌梗死为60%。支架内血栓形成的危险因素可从患者的临床特点、病变特点、介入操作因素、支架本身及聚合物涂层的影响和抗血小板药物低反应等多方面分析。前瞻性多中心研究显示,长期服用乙酰水杨酸(ASA)者有多达23%的患者发生ASA抵抗。另有报道服用氯吡格雷24小时后无反应者发生率在4%~30%,存在CPGR。但目前的指南不推荐常规血小板聚集率检测。
氯吡格雷抗血小板作用存在个体差异,提出CPGR概念,即氯吡格雷对血小板的无效抑制,国际上缺乏公认一致标准,Muller定义CPGR为600?mg负荷剂量氯吡格雷后4小时对ADP诱导的血小板聚集较基线降低<10%,10%~29%为半抵抗,>30%则为正常反应。有研究表明CPGR的发生率波动于4.2%~31%,且认为CPGR可能导致不良心血管事件增加。
CPGR发生机制尚未完全阐明,主要有外源性和内源性两种。外源性机制主要指氯吡格雷生物利用度降低,包括剂量相对不足,个体对药物的吸收性差及药物活性代谢产物水平低等因素。内源性机制主要包括:①基因多态性:主要包括血小板表面受体和CYP450 3A4类酶;②基础血小板反应性:ACS、高体重指数、糖尿病患者,特别是胰岛素抵抗的糖尿病患者的血小板反应性基础值常增高;③其他机制:包括ADP暴露增多、P2Y12通路上调等。目前,实验室检测血小板功能方法有:①血小板粘附实验;②血小板聚集率检测;③血小板功能分析仪;④VerifyNow血小板功能检测仪;⑤血栓弹力图。但这些检测手段均未广泛用于临床。且ESC共识不建议常规将血小板功能检测作为增加氯吡格雷维持剂量的标准。
CPGR的存在,促进了新型抗血小板药物的研发,新近出现的有P2Y12受体抑制剂包括普拉格雷及非噻吩并吡啶P2Y12受体拮抗剂替格瑞洛。
普拉格雷是不可逆血小板ADP P2Y12受体拮抗剂,与氯吡格雷一样需经肝脏细胞色素酶CYP450 3A4代谢后发挥作用,有研究显示普拉格雷较氯吡格雷的主要不良事件发生率显著降低,但主要出血事件及致死性出血发生率均高于氯吡格雷。
替格瑞洛是新型口服可逆的血小板ADP P2Y12受体拮抗剂,无需经肝脏代谢即直接起效。P2Y12受体抑制水平取决于血浆替格瑞洛浓度,受代谢产物影响较小。ONSET/OFFSET研究中接受阿司匹林治疗的稳定性冠心病患者中,使用替格瑞洛显示出快速起效的药理作用,替格瑞洛180 mg负荷剂量给药0.5小时后平均血小板聚集抑制(IPA)达41%,给药2~4小时后达最大IPA 89%,作用可维持2~8小时。PLATO研究入选18 624例ACS患者,均给予阿司匹林常规剂量,并随机给予替格瑞洛(180 mg负荷剂量,90 mg bid维持剂量)或氯吡格雷(300~600 mg负荷剂量及75 mg qd维持剂量),随访6~12个月,比较替格瑞洛与氯吡格雷的疗效及出血风险。结果显示,替格瑞洛治疗组主要心血管终点事件降低33%(9.8% vs. 11.7%),两组主要出血发生率无显著差别(11.6% vs. 11.2%,P=0.43),且替格瑞洛组STEMI患者PCI术后全因死亡及支架内血栓形成发生率显著降低。
本例为国内首例使用替格瑞洛患者,在阿司匹林100 mg+氯吡格雷150 mg qd双联抗血小板治疗基础上仍前后发生急性、亚急性支架内血栓事件。而最后选择新型血小板ADP P2Y12受体拮抗剂替格瑞洛,在其他条件相同情况下未再发血栓事件,可见替格瑞洛不经肝脏代谢特点,避免了基因多态性等对血小板抑制率的影响,很好地解决了CPGR问题,是支架术后患者抗血小板治疗的新选择。
上一页 [1] [2]